
温馨提示: 药品图片来自网络,仅供参考;如遇新包装上市可能存在上新滞后,请以实物为准,如有侵权,请联系删除
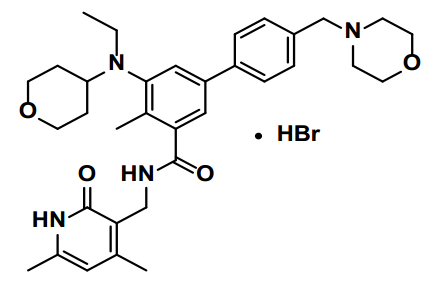
本品的主要活性成分为Tazemetostat
其化学结构如下:
1.患者选择
选择肿瘤标本中存在密码子Y646、A682或A692的EZH2突变的、复发或难治性滤泡性淋巴瘤患者接受本药治疗。
2.推荐剂量
(1)本药的推荐剂量为800mg,每日两次,口服可伴或不伴食物,直至疾病进展或出现不可接受的毒性。
(2)整片吞服,不要切、压碎或咀嚼药片。
(3)如果漏服一剂或服用本药后出现呕吐,请勿补服,但应按照用药计划继续服用下一剂。
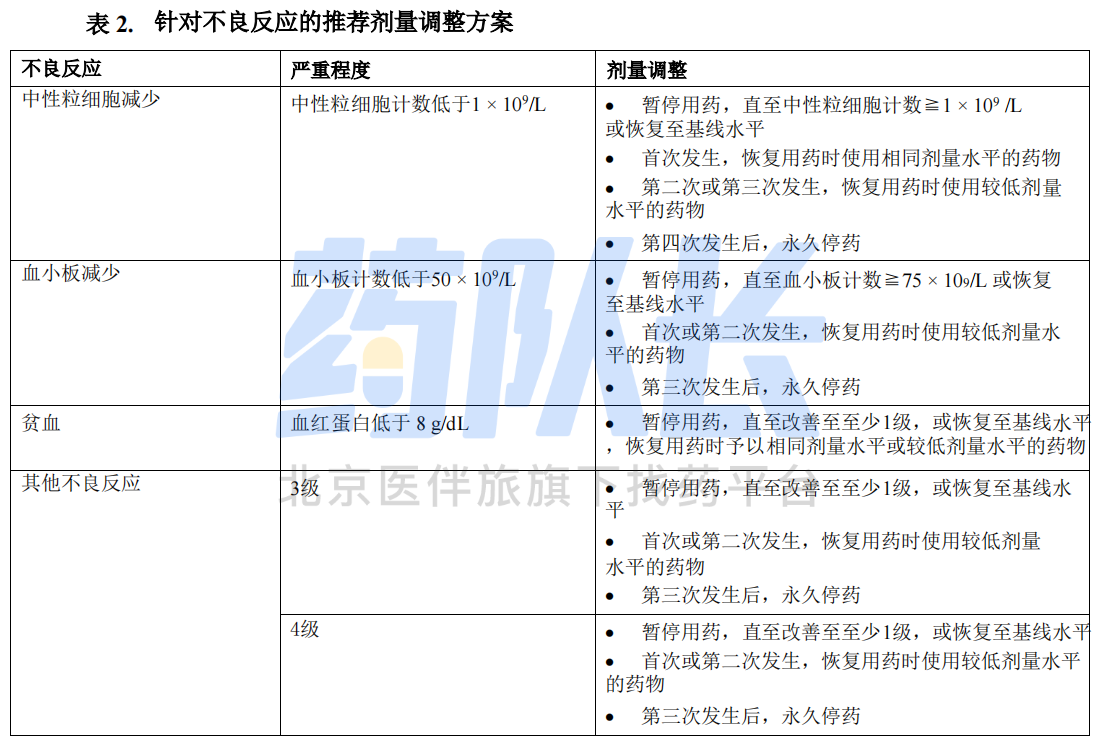
3.针对不良反应的剂量调整
表1总结了本药针对不良反应的推荐减量方案,表2总结了本药针对不良反应的推荐剂量调整方案。

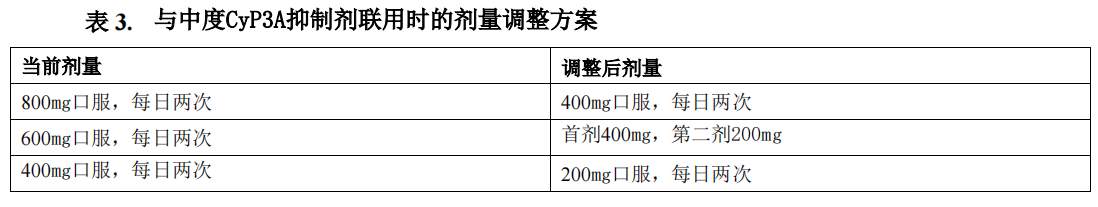
4.与强度和中度CYP3A抑制剂联用时的剂量调整
本药应避免与强度和中度CYP3A抑制剂联合使用,如果不能避免,则应减少本药的剂量,表3总结了本药与中度CYP3A抑制剂联用时的剂量调整方案,停用中度CYP3A抑制剂3个消除半衰期后,可恢复开始抑制剂治疗前本药的剂量。
1.上皮样肉瘤患者最常见(≥20%)的不良反应是疼痛、疲劳、恶心、食欲下降、呕吐和便秘。
2.滤泡性淋巴瘤患者最常见(≥20%)的不良反应是疲劳、上呼吸道感染、肌肉骨骼疼痛、恶心和腹痛。
1.继发性恶性肿瘤
本药治疗后发生继发性恶性肿瘤的风险增加,因此需长期监测患者是否发生继发性恶性肿瘤。
2.胚胎-胎儿毒性
根据动物研究结果及其作用机制,本药在给孕妇使用时可能会对胎儿造成伤害,因此需提醒孕妇注意该药对胎儿的潜在风险,建议有生育能力的女性患者在本药治疗期间和最后一剂用药后6个月内,采取有效的避孕措施,同时建议有生育能力女性伴侣的男性患者在本药治疗期间和最后一剂用药后3个月内,采取有效的避孕措施。
(以上参考自美国药监局FDA药品说明书2020.06版)
免责声明: 以上内容整理于FDA、DRUGS、网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息显示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: FDA说明书,FDA更新于2024年08月的说明书https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=211723
- 药品知识
- 药品信息
- 日本版他泽司他进医保了吗? 日本版他泽司他(Tazverik)是一种抗癌药物,主要用于治疗滤泡性淋...[ 详情 ]推荐指数:448 2023-09-01
- 日本版他泽司他(Takzetostat)的副作用? 日本版他泽司他(Takzetostat)是一种用于治疗上皮样肉瘤和滤泡...[ 详情 ]推荐指数:460 2023-08-30
- 日本版他泽司他的效果怎么样? 日本版他泽司他(Takzetostat)是一种用于治疗上皮样肉瘤和滤泡...[ 详情 ]推荐指数:713 2023-08-30
- 日本版他泽司他怎么用? 日本版他泽司他(Tazverik)是一种用于治疗复发或难治性滤泡性淋巴...[ 详情 ]推荐指数:384 2023-09-01
-
【青光眼或高眼压症】DE-117B滴眼液
[适应症]原发性开角型青光眼或高眼压症[试验分期]Ⅲ期
-
【肝功能不全】LH-1801片
[适应症]肝功能不全[试验分期]Ⅰ期
-
【系统性红斑狼疮】C-CAR168细胞回输注射液
[适应症]系统性红斑狼疮[试验分期]Ⅱ期
-
【复发脑胶质瘤】GNC-039四特异性抗体注射液
[适应症]复发脑胶质瘤(病理确诊为四级星型细胞瘤和四级胶质母细胞瘤)[试验分期]Ⅰ期










